危険物 物理化学のページです。乙4試験対策に重要な内容をこの1ページに集約しています。
- 物理:物質の分類
- 物理:物理変化
- 数値系
- 計算問題
- 化学:化学変化
- 化学:化学反応
- 試験対策の一問一答(物化10問)
 おっさん
おっさん物理化学も法令と同じ感じで乙4試験対策に絞って書くの?
 でぃでぃ
でぃでぃ物化はこのページ1枚にしちゃおうかと思ってます!
 でぃでぃ
でぃでぃ燃焼や消火に関わる内容は法令に組込んだので、残りはここペライチで。
 おっさん
おっさんここの内容だけで試験の正答率60%以上は狙える?
 でぃでぃ
でぃでぃ狙えるように内容は厳選した筈…ですよ?
 おっさん
おっさん市販の問題集とかもやった方が良いよな?
 でぃでぃ
でぃでぃそーですね、結局は理解と慣れなので問題集はやっておきましょう!
危険物-物理化学(乙4向け):物質について
【難易度:易】
物質
主に物理
危険物 乙4試験に向けた覚え方
物質の状態や変化などの整理から見ていきます。
物理寄りな内容ですが、科目名の通り物理と化学の内容を完全に分けるのは無理なので、化学の要素も入ってきます。
 でぃでぃ
でぃでぃ切ってもなかなか切り離せないのが物理と化学…
物質の分類:単体・化合物・混合物
物質を構成で分類すると以下となります。
| 分類 | どんなもの |
|---|---|
| 単体 | 1種類の原子だけで出来ている 例:酸素(O2)・水素(H2) |
| 化合物 | 複数種類の原子が結合している 例:水(H2O) |
| 混合物 | 何かと何かが混ざったもの 例:砂糖水・ガソリン・灯油 |
 おっさん
おっさんこれだけの内容で1問出てくれるんなら楽だな。
物理変化:物質の三態と沸騰
物質の状態変化を見ていきます。物質が水であれば氷る・溶ける・蒸発する、です。
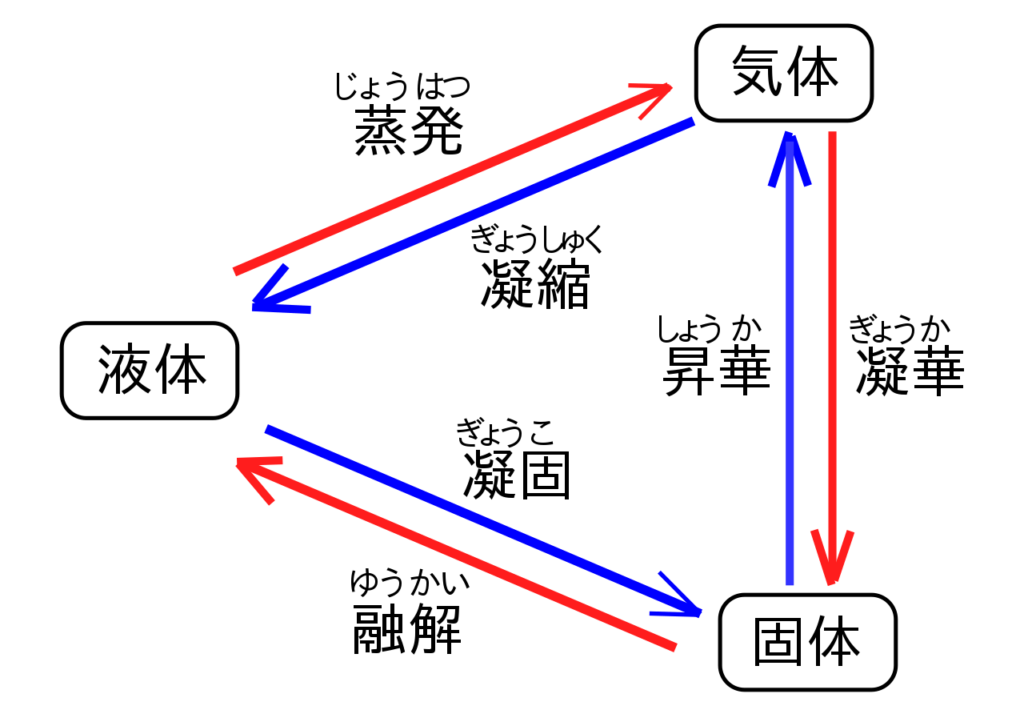
これらの変化は物理的な状態変化なので、物質の性質が変わる事ではないです。
 おっさん
おっさん固まる方の昇華と凝華は同じ意味なのか…
また、蒸発と沸騰は液体が気体になるという意味では同じですが、以下の違いがあります。
| 蒸発と沸騰 | 状況・状態 |
|---|---|
| 蒸発 | 液体の 表面だけ気化 (沸点でなくても起こる) |
| 沸騰 | 液体の 内側から気化 (沸点に達すると起こる) |
沸点の定義
(定義の要約)
物質が液体から気体へ変化する温度
(要素)
・飽和蒸気圧
→ 加熱すれば蒸気圧は上がる
→ 冷却すると蒸気圧は下がる
・外気圧(外圧)
(要素を使って乙4試験対策っぽく書くと)
・液体の飽和蒸気圧=外気圧となる温度
・沸点は物質と外気圧によって変動
 おっさん
おっさんタワマン高層階で米が炊けないのはコレだよな。
 でぃでぃ
でぃでぃ標高の高い場所は外気圧が低い=沸点も低いからお米が美味しく炊けないんですよね…
物理変化:潜熱と顕熱
熱が関わる物質の状態変化は、変化の局面で温度が変わらない状況が発生します。
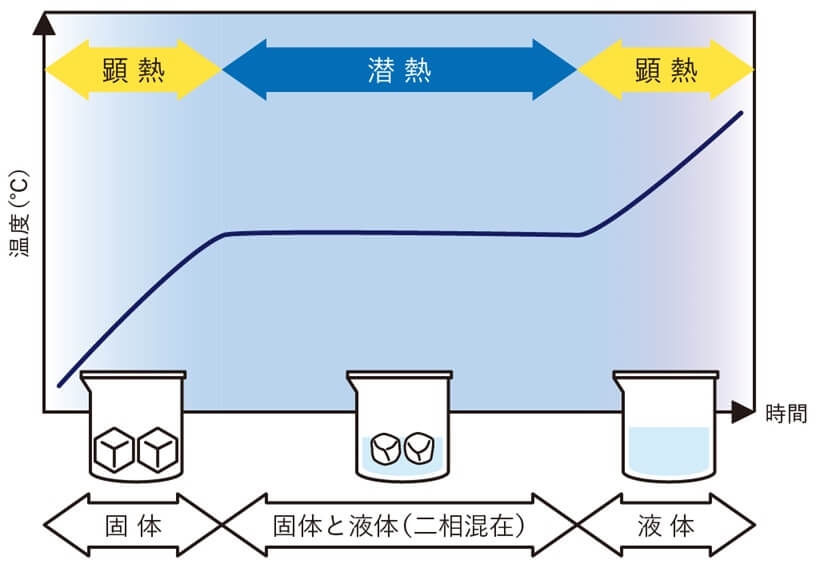
状態変化の局面での「熱」を2つに分けると、以下となります。
| 潜熱と顕熱 | 状況・状態 |
|---|---|
| 潜熱 | 物質の状態変化の途中 複数の状態が混在 温度は変わらない |
| 顕熱 | 物質は状態変化しない 状態は単一 温度は変化(上下)する |
 おっさん
おっさん「熱が潜って」状態変化をさせているイメージか。
潜熱・顕熱は物質が「熱を吸収または放出」して起こります。
物質を水である場合の潜熱・顕熱を整理してみます。
| 物質が | どうなる | 状態・例 | それは |
|---|---|---|---|
| 熱を 吸収 | 氷→水へ融解の最中・水→水蒸気へ蒸発の最中 (温度は変わらず状態変化の過程) | 氷水 沸騰中のお湯 | 潜熱 |
| 〃 | 水の温度上がる・水蒸気の温度が上がる (状態は変わらず温度が上がっている) | お湯 水蒸気 | 顕熱 |
| 熱を 放出 | 水の温度が下がる・水蒸気の温度が下がる (状態は変わらず温度が下がっている) | ぬるま湯 水蒸気 | 顕熱 |
| 〃 | 水→氷へ凝固の最中・水蒸気→水へ凝縮の最中 (温度は変わらず状態変化の最中) | 氷りかけの水 窓の結露 | 潜熱 |
 でぃでぃ
でぃでぃ物質の温度の変化が顕わなのが顕熱ですね。
物理変化:伝導・対流・輻射
熱の移動(伝わり方)についての用語解説のようなものです。
熱の移動について
・熱の伝わりやすさ=熱伝導率
・乙4の試験で熱伝導率の計算問題は出ない
・言葉だけ知っておけばOK
・熱が移動しやすいもの=熱の良導体
→ 金属など熱が移動しやすく燃えにくい
・熱が移動しにくいもの=熱の不良導体
→ 木材など熱が移動しにくいので燃える
 おっさん
おっさん乙4の試験対策では下の内容を理解すると良さそうだな。
| 何が加熱されて | どうなると | 状態・例 | それは |
|---|---|---|---|
| 固体 液体・気体 | 温度の高いところから低いところへ熱が移動 | 焼肉のトング 徐々に熱くなる | 伝導 |
| 液体・気体 | 熱い部分と冷たい部分が循環して温度が均一になる (熱くなると軽くなって動くので循環が始まる) | お風呂 | 対流 |
| 固体 液体・気体 | 熱源と非接触で(放射線で)熱が伝わる | 日光浴 赤外線治療 | 放射 (輻射) |
 でぃでぃ
でぃでぃここは簡単なので流していきましょう!
物理変化:温度と圧力による変化
物質の状態変化の要素に「温度と圧力」がある場合、どう変化するか見ていきます。
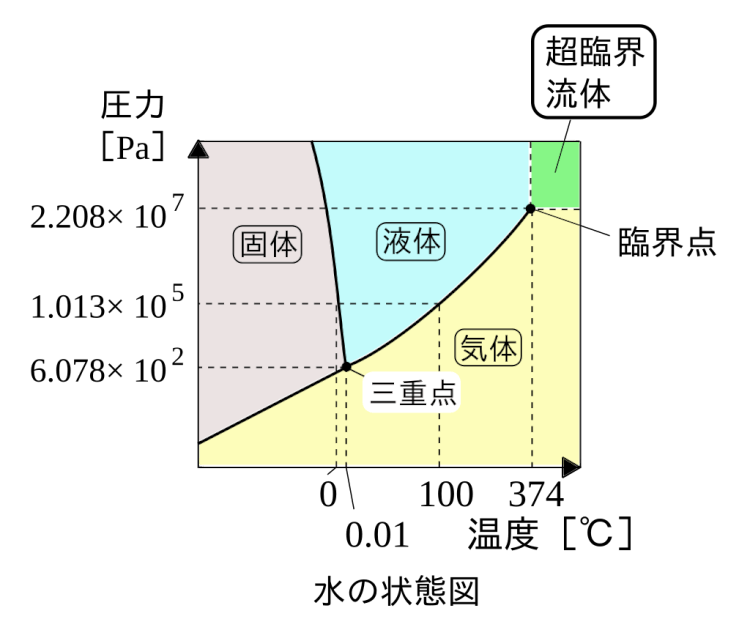
温度と圧力による状態変化
・三重点:固体・液体・気体 全てが存在
・臨界点:液体であれる限界値
(乙4試験対策の目線では…)
図が提示されて固体・液体・気体の位置を指定する問題が出る
 おっさん
おっさんこれは理屈はさておき図の配置を覚えとけって事か。
物理変化:溶解・潮解・風解
物質の状態変化の要素を「水分」とした時の用語です。
| 用語 | 何が・どうなる | 状態・例 |
|---|---|---|
| 溶解 | (固体・液体・気体が) 液体に溶けて 混合物になる | 食塩水 砂糖水 |
| 潮解 | (固体が) 空気中の 湿気を吸って 溶ける | 溶けた 盛り塩 |
| 風解 | (固体が) 空気中に 水分が蒸発して 粉になる | 炭酸Na |
乙4物質の性状に溶解は「水溶性の有無」として関わってきます。
また、他の類の危険物の性状では「潮解性」・「風解性」の有無を当たり前のように問われます。
 でぃでぃ
でぃでぃ物理変化はここまでです!
化学変化:物質の性質が変わる
物質が「化学的な変化」をする時、反応の仕方で化学変化の呼び方が変わります。
代表的な化学変化を纏めてみます。
| 例えば何が | どうなると | 何ができる | それは |
|---|---|---|---|
| 鉄 | 錆びる (鉄が酸素と結合する) | 錆びた鉄 (酸化鉄) | 酸化 |
| ガソリン | 燃える (光と熱を発しながら酸化する) | 水 二酸化炭素 | 燃焼 |
| 酸化銀 | 輝く銀色に戻る (酸化銀は黒、酸素を手放す) | 銀 | 還元 |
| お酢と重曹 | お互いの酸とアルカリを打消す (お酢は酸、重曹はアルカリ) | 水・二酸化炭素 酢酸ナトリウム | 中和 |
| 塩素とナトリウム | 結合する (化学反応を起こして結合する) | 食塩 (塩化ナトリウム) | 化合 |
| 水 | 酸素と水素に分かれる (電気分解で分解すると) | 酸素・水素 | 分解 |
| 同じ化合物 | 複数結合して別の化合物になる | ポリエチレン | 重合 |
燃焼(酸化)では化学変化に必要な酸素が不足していると、生成物も不完全なものとなります。
例:炭素(C)を酸素(O2)不足で燃やした
↓ ※本来は二酸化炭素(CO2)となるが…
できたのは一酸化炭素(CO)だった
酸化・燃焼・還元は別ページで詳しく書いています。
 おっさん
おっさん酸化と燃焼の紛らわしい引っかけ問題とかないよな?
 でぃでぃ
でぃでぃ物理化学は割と「素直な」問題が出るので、法令みたいに作問者の人間性が?っていうのはナイですね。
 でぃでぃ
でぃでぃ物質については一旦ここまでです!
危険物-物理化学(乙4向け):数値と計算問題
【難易度:並】
数値
計算問題
主に化学
危険物 乙4試験に向けた覚え方
主に化学の内容で数値系と計算問題を見ていきます。
数値の意味が判っていれば計算も簡単なので、試験での手堅い得点源にする事ができます。
 でぃでぃ
でぃでぃ数値と計算は得点源!
数値系:水比重・蒸気比重
物質が基準となるものに対してどれだけ重いかを「比重」といいます。
物質の状態で基準となるものも変わります。
| 物質の 状態 | 基準・重さ | 比重の呼び方 |
|---|---|---|
| 液体 | 水=1 1cm3=1g (4℃時点) | 液比重 (または) 水比重 |
| 固体 | 水=1 1cm3=1g (4℃時点) | 比重 |
| 気体 | 空気=1 1m3=1.3kg (標準状態) | 蒸気比重 (または) ガス比重 |
 おっさん
おっさん液比重と蒸気比重は乙4物質の性状にも関わってくるよな。
ガソリンの液比重と蒸気比重を出してみます。
| ガソリン の状態 | 基準は | 比重 |
|---|---|---|
| 液体 | 水=1 | 液比重 0.75 = 水より軽い 水に浮く |
| 気体 | 空気=1 | 蒸気比重 3.5 = 空気より重い 低所に溜まる |
液体のガソリンを川に流したら水面に浮きます。
それに火を点けたら水面が燃えながら移動して火災範囲が広がります。この事が、ガソリンの消火に水はNGとされている理由です。
 おっさん
おっさんガソリンの蒸気が溜まったマンホールとかにタバコのポイ捨てしたら…
 でぃでぃ
でぃでぃドカン!ですよ…
計算問題:比熱・熱容量・熱量
計算問題その一で、熱量の計算問題を見てみます。
計算の材料と計算式を整理します。
| 数値 | なにそれ |
|---|---|
| 比熱 | 物質 1gの温度を1℃上げる のに必要なエネルギー (例:水の比熱は4.2J) |
| 熱容量 | ある重さの物質 の 温度を1℃上げる のに必要なエネルギー 計算式:重さ(g)×比熱 |
| 熱量 | ある重さの物質 の 温度を「何℃か」上げる のに必要なエネルギー 計算式:重さ(g)×温度差×比熱 |
比熱・熱容量・熱量とも単位はエネルギーを示す(J=ジュール)です。
他の単位系と同じく1,000J=1KJ(キロジュール)、1,000,000J=1MJ(メガジュール)となります。
 おっさん
おっさんどんな計算問題が出るんかね?
危険物乙4-物理化学 計算問題①
現在の温度が20℃の水250gを50℃まで加熱する場合の熱量はいくらか。水の比熱は4.2Jとし、その他の条件は考慮しない。
(計算の材料)
①水の比熱=4.2J
②水の量=250g
③上げる温度=30℃
(50℃ – 20℃)
(計算)
計算式 = ① × ② × ③
4.2 × 250 × 30 = 31,500J
答え:31.5KJ
 おっさん
おっさんこれは1回見ておけば問題なさそうだな。
 でぃでぃ
でぃでぃ次の計算問題は少し解説を丁寧にした方がいいかもですね…
計算問題:ボイル・シャルルの法則
計算問題その二で、ボイル・シャルルの法則です。
熱膨張についてボイルシャルルの法則を使った計算問題は割とよく出題されます。
ボイル・シャルルの法則
(定義と計算式)
気体の体積は圧力に反比例し絶対温度と比例
計算式=圧力 × 体積 ÷ 絶対温度(K)
絶対温度(K)=摂氏の温度(℃)+ 273
 おっさん
おっさんコレ苦手なんだよなぁ…
ボイル・シャルルの法則が小難しいのは、2つの法則を合体させたものだからです。
分解してみると思いのほか簡単です。
ボイルの法則
気体の体積は圧力に反比例する
(どういう事?)
温度は一定の状況で気体に圧をかければ縮むという事を示し、計算は絶対温度でする
(大事なのは温度の変換)
絶対温度(K)=摂氏の温度(℃)+ 273
シャルルの法則
気体の体積は絶対温度と比例する
(どういう事?)
圧力は一定の状況で気体を加熱したら熱膨張するという事を示し、計算は絶対温度でする
(大事なのは温度の変換)
絶対温度(K)=摂氏の温度(℃)+ 273
 でぃでぃ
でぃでぃ計算の下拵えで℃→Kへの変換を必ずします。
早速、過去問っぽい計算問題を解いてみましょう。
危険物乙4-物理化学 計算問題②
27℃の窒素100ℓを327℃まで加熱した場合、窒素の体積はいくつになるか。圧力は一定とし、窒素は計算上の理想気体※として振舞うものとする。
※計算上の理想気体~は、窒素は計算通り熱膨張するよという但し書きです。
(計算の材料)
①圧力:一定、1を仮置き
②(加熱前)窒素の体積:100ℓ
③(加熱後)窒素の体積:?
④(加熱前)27℃→300K(絶対温度へ変換)
⑤(加熱後)327℃→600K(絶対温度へ変換)
(計算)
(①×②÷④)=(①×③÷⑤)
(実際の計算)
①1 × ②100ℓ ÷ ④300K = ①1 × ③? ÷ ⑤600K
→ 加熱前:100ℓ ÷ 300K = 加熱後:? ÷ 600K
→ 加熱後の体積:? = 200ℓ
 おっさん
おっさんボイル・シャルルの法則って合せ技だから小難しく感じるんだな。
 でぃでぃ
でぃでぃそーです。詰んだと思ったら分解してみると割とすんなり理解が進みます。
 でぃでぃ
でぃでぃ数値・計算問題はここまでです!
※計算問題:ボイル・シャルルの法則は、高圧ガス移動監視者のところで別パターンの計算例を出しています。
危険物-物理化学(乙4向け):化学反応などを少しだけ
【難易度:並】
化学反応
主に化学
危険物 乙4試験に向けた覚え方
化学反応の「さわり」の部分を見ていきます。
基本的な「原子とは」や「化学反応をする時の式の書き方」などを流していきます、
 でぃでぃ
でぃでぃ化学は沼っちゃうと抜け出せなくなるのでちょっとだけ…
原子と分子
化学反応の材料となる「原子」と「分子」について確認します。
| 材料 | それは何? | 例えば |
|---|---|---|
| 原子 | 物質を構成する 単一種類の材料 | 水素の原子 (記号で示すと) H |
| 分子 | 原子同士が 反応して結合 したもの | 水の分子 (記号で示すと) H2O |
原子について押さえる事
・原子は記号で表す
・原子は元素とも呼ぶ
→ 原子記号と元素記号という呼び方
→ 意味合いに大きな違いはない
・原子には種類ごとの「重さ」がある
・原子の「重さ」を原子量という
分子について押さえる事
・分子は2つ以上の原子が結合したもの
・結合するのが同じ種類同士でも分子となる
→ 例:水素原子(H)が2つ結合
→ この場合は水素分子(H2)となる
・分子の「重さ」は原子の重さの合計
・分子の「重さ」を分子量という
→ 例:水の分子(H2O)はH2個とO1個
→ この「原子それぞれの重さ」を足す
 おっさん
おっさん基本的な事だから抜け・漏れが無い様にしないとな…
原子の覚え方は人それぞれですが、最低限で以下のものは覚えておきましょう。
| 原子 | 原子記号 | 原子量 |
|---|---|---|
| 水素 | H | 1 |
| 炭素 | C | 12 |
| 窒素 | N | 14 |
| 酸素 | O | 16 |
| 塩素 | Cl | 35.5 |
 でぃでぃ
でぃでぃ赤字は計算問題で暗記を求められる事もあります!
化学反応:元素の周期表
ここから先は化学反応について見ていきます。

上の図は学校の授業(理科・化学)でも必ず見るもので、左上→右横への読みで原子番号の順に原子を並べたものです。
表の縦軸・横軸は…
- 横軸:「族」と呼び、横並びに1-18族の分類
- 縦軸:「周期」と呼び、縦並びで「同じ族」
 でぃでぃ
でぃでぃ授業の時に謎の語呂合わせを唱和させられた人も多いかもです…
乙4の試験対策をする目線では「4つの族」がどういうものか理解しておくと楽です。
1族・2族:アルカリ金属等
表の1族と2族は主にアルカリ金属やアルカリ土類金属が縦に並んでいて、化学反応を起こしやすいので様々な物質の材料となる
これらは金属単体の危険物として乙3物質としても扱われる
乙4の性状と消火で出てくる粉末消火剤(炭酸水素塩類)は、これら金属の化合物である
17族:ハロゲン
表の17族は消火剤でお馴染みのハロゲン
ハロゲンは基本的に不燃性でこれらを含む化合物が消火剤として使われる
18族:希ガス
表の18族は希ガスで消火剤・不活性ガスとして使われ、代表的なものにアルゴンガスが存在する
希ガスは燃えない気体なので電気火災など水を使えない消火場面で活躍
 おっさん
おっさんハロゲンの語呂合わせってアレなんだよな。大声で読むか?
 でぃでぃ
でぃでぃたぶんセクハラになるんで電気陰性度の「フォン狂っちゃう」くらいに留めて下さい…
化学反応:イオン化傾向
化学反応の基本的な事として「イオン化傾向」が出てきます。
イオン化傾向について押さえる事
・雑に言うと金属原子の反応のしやすさ
= 金属原子が陽イオンと化す傾向の強さ
・原子はもともと中性
・原子が何らかの影響を受けると電子を放出
(陽イオンの生成、主語は原子)
・電子を放出することによって+に帯電
・+に帯電している原子=陽イオン
(陰イオンの生成、主語は原子)
・電子を他の原子が受け取ると-に帯電
・-に帯電している原子=陰イオン
(イオン化傾向の覚え方)
出てくる物質数が多いので強引な語呂合わせを何度も読み書きして「口と手に」覚えさせる
試験対策をするにあたり陽イオン・陰イオンは極めて重要なので、改めて表に落とします。
| イオン | 原子が電子を | 帯電 |
|---|---|---|
| 陽イオン | 放出して 陽イオンに なる | +に帯電 |
| 陰イオン | 受取って 陰イオンに なる | -に帯電 |
 おっさん
おっさん覚える事は少しあるが、難しいもんでもないな。
イオン化傾向の語呂合わせを読んでみます。
最初の「か」はカリウム(K)で、イオン化傾向が一番強く(=陽イオンになりやすく)、最後の金(Au)はイオン化傾向が一番弱いです。
貸そう か な、ま あ ア テ に す ん な、ひ…ど す ぎん 借 金
語呂合わせを拡張して解説します。イオン化傾向は上が強く・下へ行くほど弱いです。
貸そう(K:カリウム)
か(Ca:カルシウム)
な(Na:ナトリウム)
▼
ま(Mg:マグネシウム)
あ(Al:アルミニウム)
▼
アテ(Zn:亜鉛)(Fe:鉄)
に(Ni:ニッケル)
すんな(Sn:スズ)(Pb:鉛)
▼
ひ…(H:水素)
どす(Cu:銅)(Hg:水銀)
ぎん(Ag:銀)
借金(Pt:白金)(Au:金)
余談というか小ネタで、金などは酸化しにくい性質もあって「貴金属」と呼ばれ、逆に酸化しやすいカリウムなどは「卑金属」とも。
 おっさん
おっさん語呂合わせが出来るだけで1点取れるんならオイシイぞ。
 でぃでぃ
でぃでぃまあアテにすんな、です!
化学反応:酸と塩基
こちらも化学反応の基本的な事で「酸(酸性)と塩基(アルカリ性)」が出てきます。
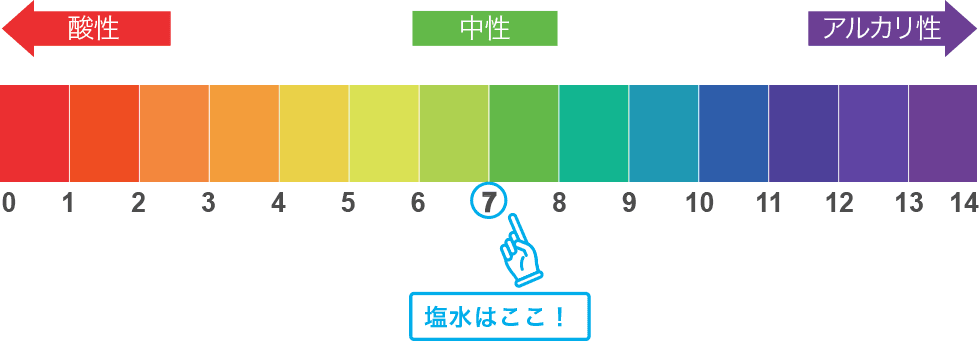
水や何かしらの水溶液が酸性またはアルカリ性、どちら側の性質か調べたりしますね。
酸と塩基について押さえる事
・液体の性質はリトマス試験紙などで計る
・画像のはpHスケーラーの例
・酸の度合いが強ければ液体は酸性
・塩基の度合いが強ければ塩基性
・塩基性はアルカリ性ともいう
・性質の尺度はpH(0.0~14.0)で示す
・中性を示すのはpH7.0の水や食塩水
・pH=水素イオン指数、呼び方はピーエイチ
 おっさん
おっさんpHを昔はペーハーと呼んだんだが、今はピーエイチが標準らしいな…
酸と塩基の定義を並べて見比べます。相反する性質なので、各々反対の事を書いているだけですが…
- 青色リトマス試験紙を赤変
- pHは0.0~6.9の範囲
- 金属と反応して水素を発生
- 水に溶けて水素イオンを生じる
- 他の物質に水素イオンを与える
- 水素イオンはH+
- 赤色リトマス試験紙を青変
- pHは7.1~14.0の範囲
- 酸と中和反応をする
- 水に溶けて水酸化物イオンを生ず
- 他の物質から水素イオンを受取る
- 水酸化物イオンはOH-
 おっさん
おっさん酸とアルカリをちょうど良く混ぜたら…
 でぃでぃ
でぃでぃ中和反応をして中性の塩水(エンスイ)になりますね。
化学反応:化学反応式
酸性の液体とアルカリ性の液体を混ぜた時の反応を式で示します。
化学反応について理解する事
・ちょうど良く中和すれば液性は中性
・酸と塩基の一方が強いと強い液性が残る
・中和反応すると水と塩(エン)を生成
・塩(エン)は生成物を示す言葉
・食塩は塩(エン)の一種
・食べてはいけない塩(エン)も存在する
・化学反応は式で示す
・式はパターンによって「お作法」がある
 おっさん
おっさん式の「お作法」とか試験で出るんかな?
酸性の液体(塩酸)とアルカリ性の液体(水酸化ナトリウム水溶液)を混ぜて中和させた場合の化学反応式を見てみます。
化学反応式
(化学反応式のお作法)
・反応前:左辺 → 反応後:右辺
・左辺と右辺の間は「→」
HCl + NaOH → NaCl + H2O
酸 + アルカリ → 塩(エン)+ 水
(反応の結果)
中和反応で塩化ナトリウムと水が生成された
(余談)
中和が完全なものであれば、反応後の液体は食塩水となり飲む事も「理屈上は」可能(非推奨だが)
 おっさん
おっさんこれ、中和が不完全なの飲んだら危ねーよな?
 でぃでぃ
でぃでぃ口内や喉の粘膜が焼けますね…
化学反応:熱化学方程式
化学反応に関する式で「熱化学方程式」を見ていきます。
熱化学方程式について理解する事
・化学反応式とは別モノ
・方程式なので左辺と右辺の間は「=」
・分子式それぞれの右側に状態も書く
・状態によって発生する熱も変わるから
(必須ではないが…)
・生成物が1molとなるように書く事もある
 おっさん
おっさん方程式だから「=」ってのは理解しやすいな。
水素と酸素(どちらも気体)が反応して水(液体)が生成された場合の熱化学方程式を見てみます。
熱化学方程式
(熱化学方程式のお作法)
・分子式(態) = 分子式(態)+ 熱量(J)
・左辺と右辺の間は「=」
H2(気)+ 1/2 O2(気)= H2O(液)+ 286KJ
水素 + 酸素 = 1molの水 + 発熱
(化学反応式で書くと)
2H2 + O2 → 2H2O
(知っておくこと)
熱化学方程式の右辺に入る熱量は発熱反応では「+」となるが、吸熱反応の場合は「-」となる
 おっさん
おっさんこのページの内容もここで打ち止めかね。
 でぃでぃ
でぃでぃそーですね、ここまでの内容で乙4の試験対策は大丈夫かなーと思います。
 でぃでぃ
でぃでぃ法令⑥の燃焼のところも物理化学に関係するので、見ておくと良いかもです!
危険物-物理化学(乙4向け):試験対策の一問一答
このページで出てきた内容から試験対策っぽいものを作ってみました。
 でぃでぃ
でぃでぃ一問一答形式で確認していきましょう!
問題右端の+ボタンで答えが出てきます。
問1:ガソリンと灯油は純物質だっけ?
ばつ!混合物です。
問2:外気圧が上がると沸点も高くなるって本当?
まる!
問3:潜熱は物体の温度が上昇している時の温度だったかな…?
ばつ!それは顕熱です。
問4:固体が空気中の湿気を吸って溶けるのを風解というんだよね?
ばつ!それは潮解です。
問5:ガソリンの蒸気は空気より重い=蒸気比重は1より大きい?
まる!
問6:水の比熱は4.2J、100gの水温を10℃上げるのに必要な熱量は4.2KJで良い?
まる!
問7:圧力と温度は一定で絶対温度を倍にしたら気体の体積も2倍になる?
まる!
問8:元素の周期表で1族はハロゲン、2族は希ガスだったっけ?
ばつ!1族はアルカリ金属等、2族はアルカリ土類金属等です。
問9:イオン化傾向の語呂「貸そうかな」の中で鉄は出てくる?
ばつ!続きの「まあアテにすんな」のテです。
問10:水溶液が塩基(アルカリ)性だとリトマス試験紙は赤くなるんだよね?
ばつ!赤くなるのは酸性です。
 おっさん
おっさんすげー勉強した気になって疲れたぞ…
 でぃでぃ
でぃでぃ試験対策に必要なのは全部ブッ込みましたね。
 おっさん
おっさんこの後は問題集をやって良いんだよな?
 でぃでぃ
でぃでぃそーですね、結局は問題集で慣れたモノ勝ちの試験ですから…
 おっさん
おっさんOK、インプットしたらすぐにアウトプットだな。
 でぃでぃ
でぃでぃおっさんがまともな事を言うのって、だいたいが疲れ切ってる時ですよね。
 でぃでぃ
でぃでぃお疲れさまでした!
次のページからは危険物 第四類(乙4)の勉強では一番楽と言われる性状・取扱・消火を見ていきます。
■危険物 第四類(乙4)ページ一覧
①:第四類の概要
②:関係法令のカテゴリトップ
③:法令1 資格・免状・申請
④:法令2 指定数量・予防規定・諸手続
⑤:法令3 役職者・施設概要・取扱
⑥:法令4 製造所・取扱所
⑦:法令5 貯蔵所・製造所等まとめ
⑧:法令6 燃焼・消火・警報
⑨:物理化学・計算問題 ◀NOW
⑩:性状と消火1 危険等級Ⅰ・Ⅱ
⑪:性状と消火2 危険等級Ⅲ


